

推奨
クラス
エビデンス
レベル
Minds
推奨
グレード
Minds
エビデンス
分類
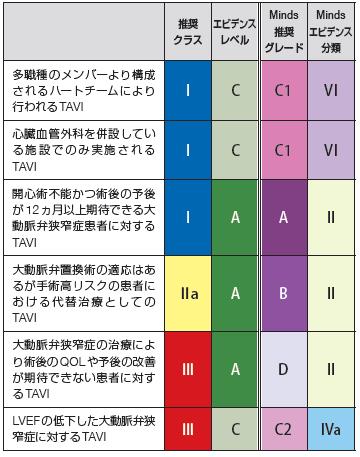
多職種のメンバーより構成
されるハートチームにより
行われるTAVI
I C C1 VI
心臓血管外科を併設してい
る施設でのみ実施される
TAVI
I C C1 VI
開心術不能かつ術後の予後
が12ヵ月以上期待できる大
動脈弁狭窄症患者に対する
TAVI
I A A II
大動脈弁置換術の適応はあ
るが手術高リスクの患者に
おける代替治療としての
TAVI
Ⅱa A B II
大動脈弁狭窄症の治療によ
り術後のQOLや予後の改善
が期待できない患者に対す
るTAVI
Ⅲ A D II
LVEFの低下した大動脈弁狭
窄症に対するTAVI
現時点における経カテーテル的大動脈弁留置術(TAVI)または経カテーテル的大動脈弁置換術(TAVR)の適応疾患は高度大動脈弁狭窄( AS) で,
その手術適応や手術時期については大動脈弁置換術に準じており(表66),詳細については最近の各ガイドラインを参照されたい560, 561, 787).
一般に心不全を合併した患者は高リスク症例である可能性が高く,手術リスクを包括的に評価したうえで,各種治療法のリスク・ベネフィットを十分に
検討し,最適な治療法を選択する.手術やカテーテルインターベンションによる治療を検討する必要がある弁膜疾患症例では,いわゆる“ハートチーム”に
よる治療方針の決定が重要である788, 789).ハートチームは,弁膜疾患診療のスペシャリストで構成されるべきで,そのなかには循環器内科医,心臓外科
医,構造的心疾患(structural heart disease; SHD)インターベンション医,画像診断医,麻酔科医,老年科医,集中治療医などの多職種のスタッフが含
まれる.治療リスクの評価については,手術関連のリスク評価にはEuropean System for Cardiac Operative Risk Evaluation(EuroSCORE)や米国胸
部外科学会(Society of Thoracic Surgeons; STS)スコアが有用であるが790, 791),スコアに含まれない臓器合併症,放射線治療歴やporcelain aortaな
どの手術を困難にする因子,脆弱性(frailty)などを考慮し,総合的に判断することが必要である560, 788, 792- 795).
TAVIは,ハートチームにより手術不適と判断され,術後の生命予後が1年より長く期待される重症AS患者において推奨される796-799).また,手術が適応
可能であっても,個々のリスクや解剖学的条件から,‘ ハートチーム’によってTAVIのほうが好ましいと判断された高リスク症例でもTAVIを検討すべきであ
る798- 801).一方で,治療により症状やQOLの改善が期待できない患者は適応から外れる788, 796 - 799).
TAVIの適応に関しては,上述の患者選択以外に解剖学的条件も重要である.弁輪部を含む大動脈基部解剖の描出に長ける心電図同期マルチスライス
CTや心エコー法,冠動脈造影検査など,詳細な術前画像診断を行ったうえで,使用するデバイスや弁のサイズ,アプローチを総合的に判断する.
一般にTAVIに適さない解剖学的要件として,TAVIデバイスで対応不能な大動脈弁輪径,左室内血栓,活動性の心内膜炎,冠動脈口閉塞のリスクが高い
状態( 不均一な分布の弁石灰化病変,冠動脈入口部低位や小さなバルサルバ洞など),上行および弓部大動脈の可動性を伴うプラークなどがあげられる
561, 787).解剖学的適応に関しては,TAVIデバイスの進化により大きく変化することが予想され,今後の動向に注意が必要である.
実際の患者選択や手技,周術期の管理に至るまで,ハートチーム全体で取り組むことが重要で,国内では経カテーテル的大動脈弁置換術関連学会協
議会が定める実施施設基準には,手術実績,設備機器,人員,施設の資格要件,レジストリー登録が定められており,人員の要件のなかにハートチーム
の形成が含まれている.これらをすべて満たした施設でのみTAVIの実施が可能となっている561, 802).
左室機能低下の高度AS症例では,low-flow,lowgradientの病態( 弁口面積<1 cm2,LVEF<40%,平均圧較差<40 mmHg) に注意が必要で,
その鑑別にはドブタミン負荷エコーが有用である803, 804).後負荷増大が原因と限定できない左室機能低下例では,左室機能および症状の完全な改善は
期待できないが,生命予後は改善する805).
低心機能症例に対するTAVIの成績に関しては,良好な術後早期成績を示す報告がある一方で806, 807),低心機能自体が術後の予後不良因子であると
する報告もあり808, 809),その有効性に関しては一定の見解が得られていないのが現状である.心機能低下例へのTAVIの適応については慎重な姿勢で
のぞむ必要がある.
1.2TAVI
表66 大動脈弁狭窄症に対するTAVI の推奨とエビデンスレベル
急性・慢性心不全診療ガイドライン(2017年改訂版)
Guidelines for Diagnosis and Treatment of Acute and Chronic Heart Failure
(JCS 2017/JHFS 2017)